Lorem ipsum dolor sit amet, consectetur adipiscing elit. Cras eleifend turpis vel lectus vulputate, nec suscipit neque mattis. In dictum lacus orci, at bibendum dolor efficitur eu. Suspendisse non faucibus libero. Donec varius, dolor a pulvinar pulvinar, libero nisi rutrum lorem, eu aliquet nulla lectus eget ipsum. Aenean porta sapien vel nisi tincidunt molestie. Curabitur ut mi quis elit mattis ultricies non ac mauris. Sed fermentum ligula et tristique congue. Phasellus et mi diam. Quisque rutrum sem ac sem eleifend, at laoreet ex rutrum. Maecenas convallis non tortor eu ultricies. Nulla rutrum odio id elit sagittis scelerisque. Maecenas a neque non purus mattis maximus sagittis nec arcu. Phasellus eget pulvinar dolor. Mauris faucibus ante enim, non sollicitudin odio posuere non. Etiam at semper diam. Sed pellentesque cursus lectus, vel malesuada dui posuere a. Fusce sit amet tellus vitae lectus laoreet rhoncus. Praesent rhoncus risus id urna pellentesque, ac suscipit est volutpat. Nullam cursus at velit ac interdum. Mauris vel sapien ante. Integer sit amet mollis ex.
Lorem ipsum dolor sit amet, consectetur adipiscing elit. Cras eleifend turpis vel lectus vulputate, nec suscipit neque mattis. In dictum lacus orci, at bibendum dolor efficitur eu. Suspendisse non faucibus libero. Donec varius, dolor a pulvinar pulvinar, libero nisi rutrum lorem, eu aliquet nulla lectus eget ipsum. Aenean porta sapien vel nisi tincidunt molestie. Curabitur ut mi quis elit mattis ultricies non ac mauris. Sed fermentum ligula et tristique congue. Phasellus et mi diam. Quisque rutrum sem ac sem eleifend, at laoreet ex rutrum. Maecenas convallis non tortor eu ultricies. Nulla rutrum odio id elit sagittis scelerisque. Maecenas a neque non purus mattis maximus sagittis nec arcu. Phasellus eget pulvinar dolor. Mauris faucibus ante enim, non sollicitudin odio posuere non. Etiam at semper diam. Sed pellentesque cursus lectus, vel malesuada dui posuere a. Fusce sit amet tellus vitae lectus laoreet rhoncus. Praesent rhoncus risus id urna pellentesque, ac suscipit est volutpat. Nullam cursus at velit ac interdum. Mauris vel sapien ante. Integer sit amet mollis ex.
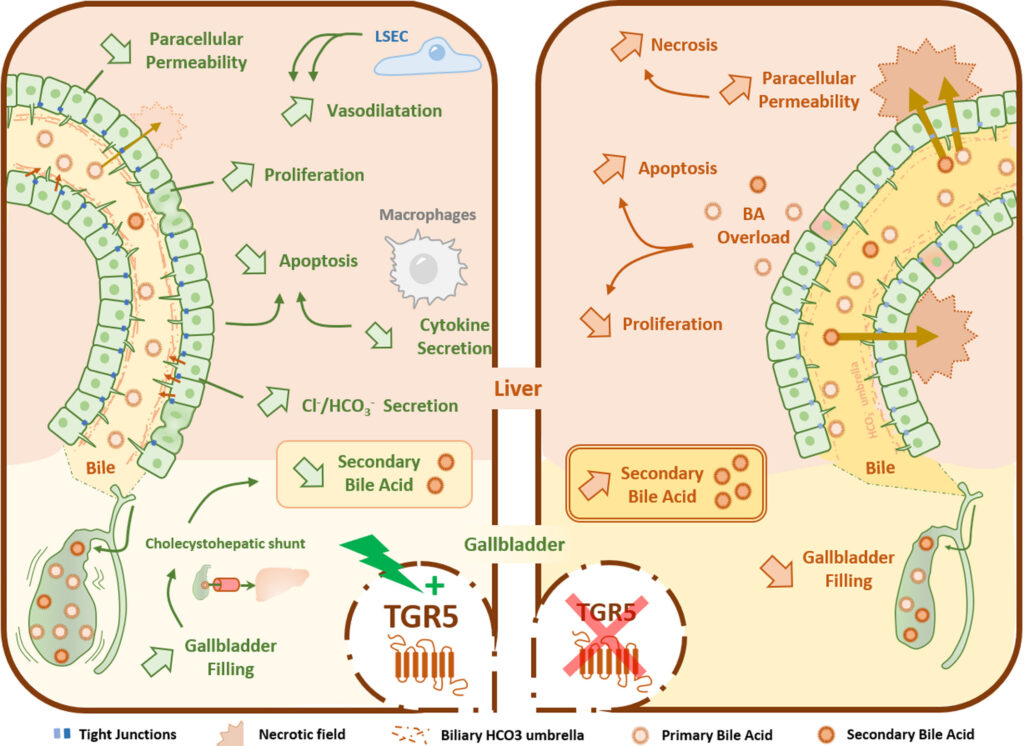
Même si la capacité de régénération du foie est importante, la réparation tissulaire lors de lésions chroniques (d’étiologies biliaires ou non biliaires) peut entraîner une fibrose hépatique. Il est important de noter qu’après une blessure et pendant la réparation du foie, les fonctions hépatiques doivent être maintenues pour assurer la demande périphérique. Ceci est particulièrement critique pour la sécrétion de la bile, qui doit être finement réglée afin de préserver le parenchyme hépatique d’une blessure induite par les acides biliaires. Cependant, les mécanismes permettant au foie de maintenir l’homéostasie biliaire pendant la réparation après une blessure ne sont pas complètement compris. Dans ce contexte, nos travaux sont axés sur les relations mutuelles entre l’homéostasie biliaire et la réparation du foie. Une attention particulière est portée aux acides biliaires et à leurs récepteurs (notamment TGR5) comme cibles thérapeutiques potentielles. A cette fin, nous utilisons des modèles in vivo (souris) de surcharge en acides biliaires et in vitro (culture d’hépatocytes et de cholangiocytes), ainsi que des échantillons hépatiques humains (tissus et cellules isolées).
Figure: Représentation schématique des différents mécanismes d’hépato-protection médiés par TGR5. L’intégrité de la barrière hémato-biliaire (BHE), qui sépare le sang de la bile, est essentielle dans les conditions physiologiques et pathologiques. La stimulation du récepteur TGR5 favorise la prolifération des cholangiocytes et la fonction de barrière en renforçant les jonctions serrées des cholangiocytes. TGR5 régule le transport des ions chlorure et bicarbonate dans la bile, réduisant ainsi la protonation des acides biliaires et protégeant le parenchyme hépatique de la cytotoxicité des mêmes acides biliaires. TGR5 a un impact physiologique sur les fonctions de la vésicule biliaire, y compris sur la réabsorption des acides biliaires identifiée comme le shunt cholécysto-hépatique, limitant la quantité d’acides biliaires secondaires toxiques. La signalisation médiée par les acides biliaires via TGR5 réduit le tonus vasculaire hépatique et la pression portale, résultant d’une vasodilatation sinusoïdale (d’après Merlen et al., Liver Int 2020;40(5):1005-1015).
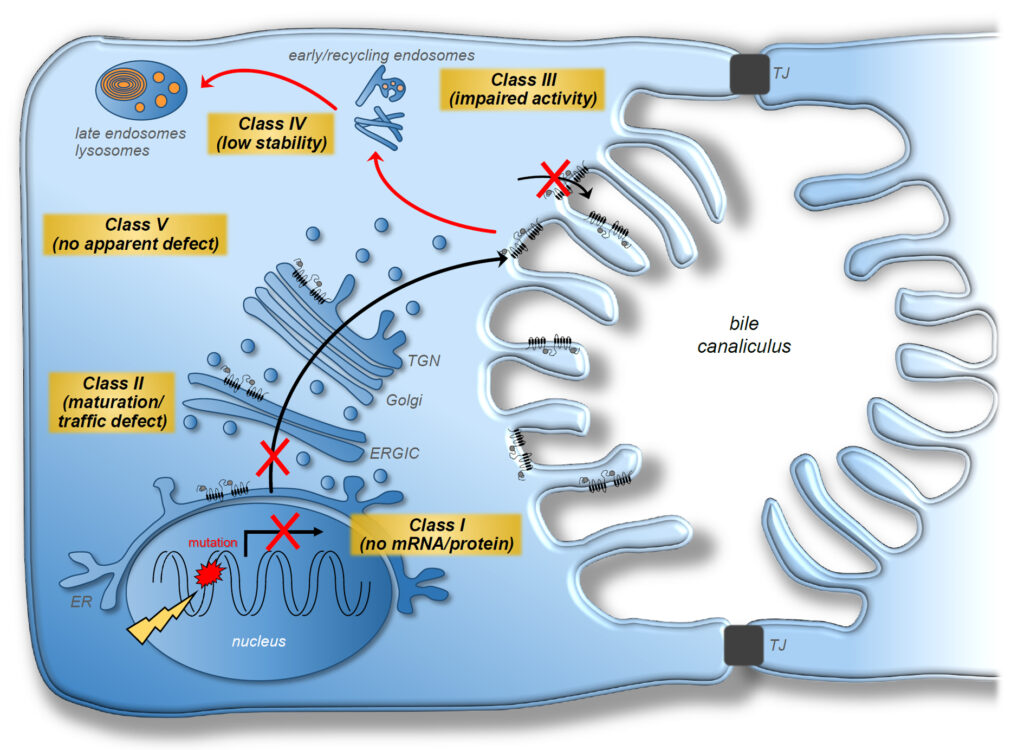
Les maladies hépatiques cholestatiques chroniques peuvent avoir des origines génétiques en lien avec des défauts moléculaires des transporteurs ABC (ATP-Binding-Cassette) localisés au niveau de la membrane canaliculaire des hépatocytes. En effet, les variations génétiques d’ABCB11/BSEP (transporteur des acides biliaires) et d’ABCB4/MDR3 (transporteur de phospholipides) sont impliquées dans des formes rares et sévères de cholestases génétiques appelées cholestases familiales intrahépatiques progressives de types 2 et 3, respectivement. Ces maladies se caractérisent par une cholestase (arrêt ou diminution de l’écoulement de la bile), un ictère (jaunisse) et un prurit (démangeaisons) modéré à sévère, et évoluent le plus souvent vers une insuffisance hépatique, nécessitant alors une transplantation hépatique. L’objectif de nos travaux est d’identifier de nouvelles molécules capables de corriger les défauts des transporteurs ABC canaliculaires mutés (expression, trafic ou fonction), dans le cadre de ces maladies cholestatiques. Pour cela, nous utilisons des modèles cellulaires exprimant les transporteurs ABC canaliculaires défectueux afin d’identifier des molécules d’intérêt thérapeutique capables de restaurer leur synthèse, leur trafic intracellulaire et/ou leur fonction. A terme, les molécules les plus pertinentes seront validées à un stade préclinique dans des modèles murins mimant les pathologies humaines avant d’envisager leur transfert auprès des patients dans une perspective de médecine personnalisée.
Figure : Représentation schématique des classes de variants génétiques des transporteurs ABC canaliculaires. Les classes ont été déterminées en fonction du déficit identifié dans des modèles cellulaires. La classe I correspond à des variants non-sens (codon stop prématuré) aboutissant à une expression protéique extrêmement réduite, voire nulle. Les variants de classe II, III et IV sont principalement des variants faux-sens (remplacement d’un acide aminé par un autre) dont le déficit est lié à des défauts de trafic intracellulaire, d’activité ou de stabilité, respectivement. Les variants de classe V ne présentent aucun défaut apparent, identifiable par les approches expérimentales utilisées et pourraient correspondre à des polymorphismes non délétères (d’après Vauthier et al., Biochem Pharmacol 2017;136:1-11).
La construction au cours de l’embryogenèse et le maintien d’un système biliaire fonctionnel impliquent notamment le cil primaire, dont des dysfonctions sont associées à des ciliopathies biliaires. Bien que de nombreux travaux aient permis d’élucider le rôle du cil primaire des cholangiocytes dans la signalisation et la régulation de l’homéostasie biliaire, sa fonction dans l’organogénèse biliaire reste à élucider. Dans ce contexte, nous développons nos travaux selon deux axes :
Des mécanismes moléculaires et cellulaires permettent aux cellules (incluant les cellules hépatiques) de s’adapter à différents stress : infectieux, oxydant (lié au vieillissement ou à des maladies), osmotique et ionique, privation d’oxygène ou de nutriments (ischémie, cancer), accumulation de lipides (stéatose / MASLD) ou de nanoparticules (environnement), compression mécanique (fibrose / MASH), hypothermie (conservation des greffons), chimiothérapies anticancéreuses, du stress golgien (Désordres Congénitaux de la Glycosylation / CDG).
Dans le thème 1 nous explorons :
1- Les rôles du cytosquelette et d’organites membranaires comme senseurs de stress hépatiques et médiateurs moléculaires des réponses cellulaires
2- Le rôle du Golgi comme site de production de biomarqueurs circulants en situation de stress hépatiques
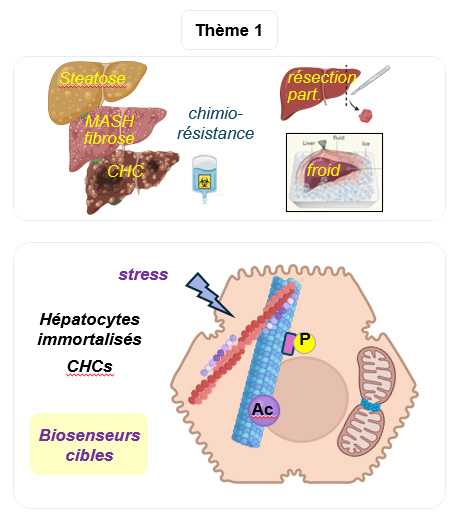
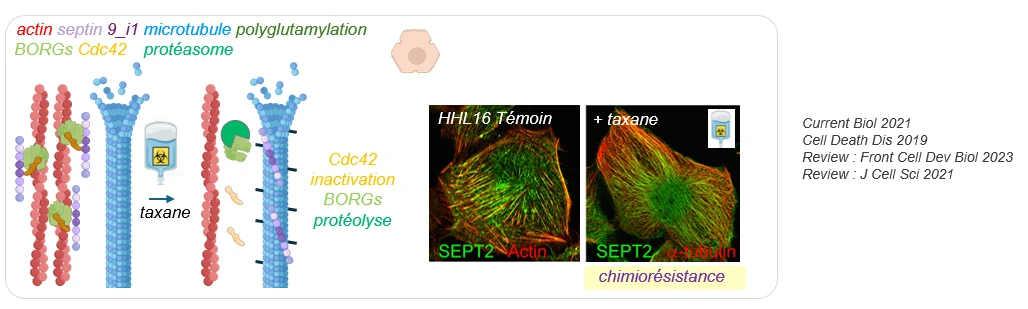
Remaniements du cytosquelette et chimiorésistance aux taxanes
Les taxanes sont des stabilisateurs des microtubules utilisés efficacement pour le traitement des cancers du sein, de l’ovaire et de la prostate, mais leur emploi est limité par des chimiorésistances innées ou acquises.
Nous avons révélé dans des hépatocytes un nouveau mécanisme initiateur de résistance acquise impliquant un remodelage du cytosquelette où les filaments de septines se relocalisent des fibres de stress d’actine vers les microtubules qui retrouvent alors leur dynamique.
Le rôle précoce de l’inactivation de Cdc42 par les taxanes et de la dégradation des protéines BORGs par le protéasome dans ce remaniement, ouvre des perspectives pour identifier de nouveaux biomarqueurs de chimiorésistance. Manipuler ce mécanisme permettrait une utilisation plus générale des taxanes, comme dans des cancers agressifs et multirésistants tels que les hépatocarcinomes (CHCs).
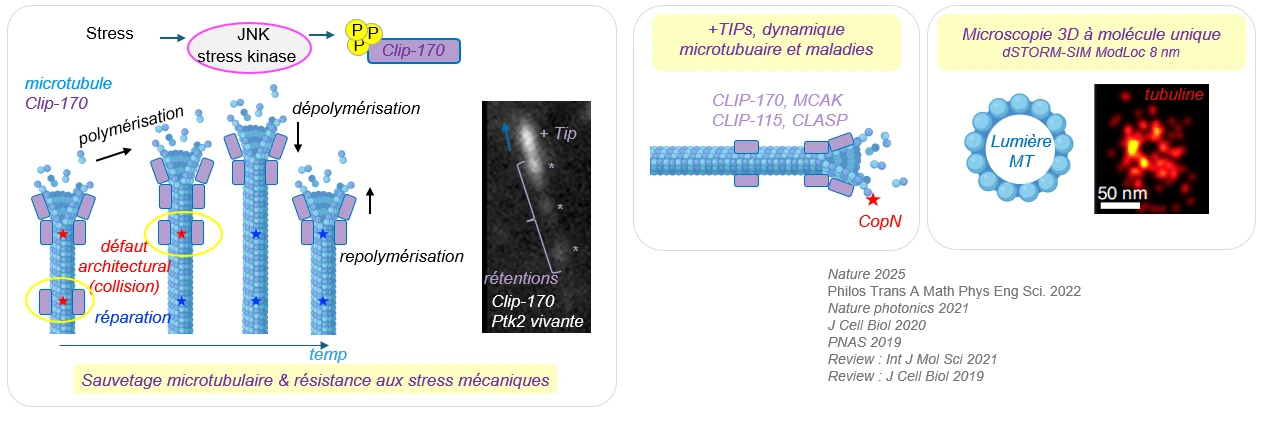
Protéines +TIPs et dynamique microtubulaire
Les protéines +TIPs sont des protéines qui s’associent avec les extrémités ‘plus’ des microtubules en croissance, formant ainsi des comètes. Nous nous sommes intéressés dans des contextes de maladies aux protéines +TIP CLIP-170, CLIP-115, CLASP, MCAK, mais aussi à la protéine bactérienne CopN.
Nous utilisons la microscopie à haute résolution pour imager la structure du cytosquelette.
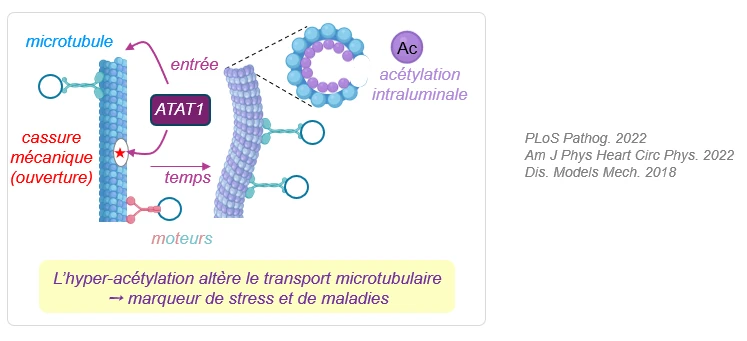
Acétylation des microtubules
L’acétylation des microtubules sur la lysine 40 (K40) requiert l’acétyl-transférase alphaTAT1/Mec17 pour réguler la dynamique microtubulaire, la rigidité des microtubules et l’activité des transporteurs moléculaires.
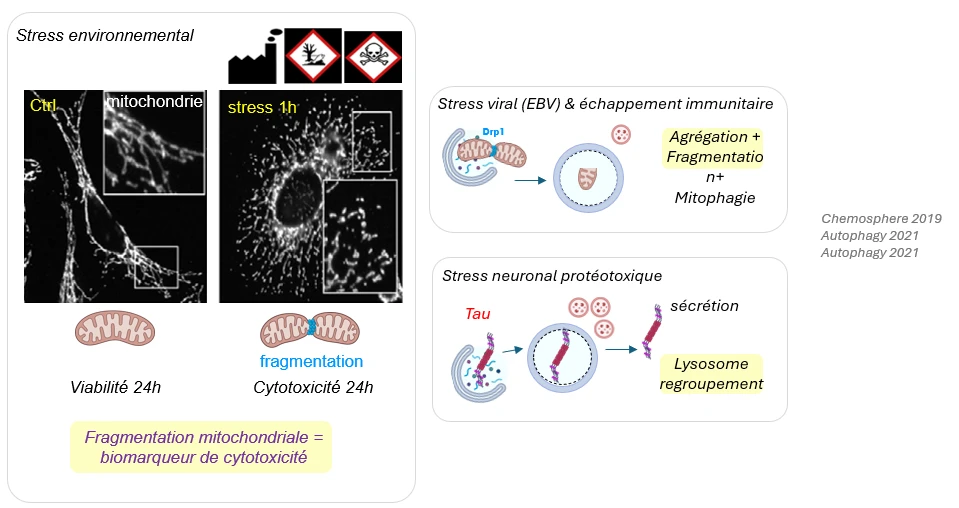
Nous avons montré que l’hyper-acétylation des microtubules est une réponse fréquente à différents stress, retrouvée aussi dans des maladies telles que l’obésité cardiaque, la réactivation virale d’Epstein-Barr par échappement à l’immunité innée et la paraplégie spastique familiale. Dans ces exemples, cette modification post-traductionnelle altère l’import du glucose, le transport mitochondrial ou neuronal.
L’acétylation peut donc être utilisée comme un marqueur de stress cellulaire, mais aussi envisagée comme une nouvelle cible thérapeutique.
Mitochondries, lysosomes et stress
Les mitochondries et les lysosomes sont non seulement transportés par les microtubules, mais leur dynamique (fusion, fission) et activité dépendent aussi du cytosquelette.
La fragmentation des mitochondries et l’agrégation protéique sont des marqueurs précoces de stress qui peuvent induire de l’autophagie pour que ces entités cytotoxiques soient dégradées et recyclées par les lysosomes.
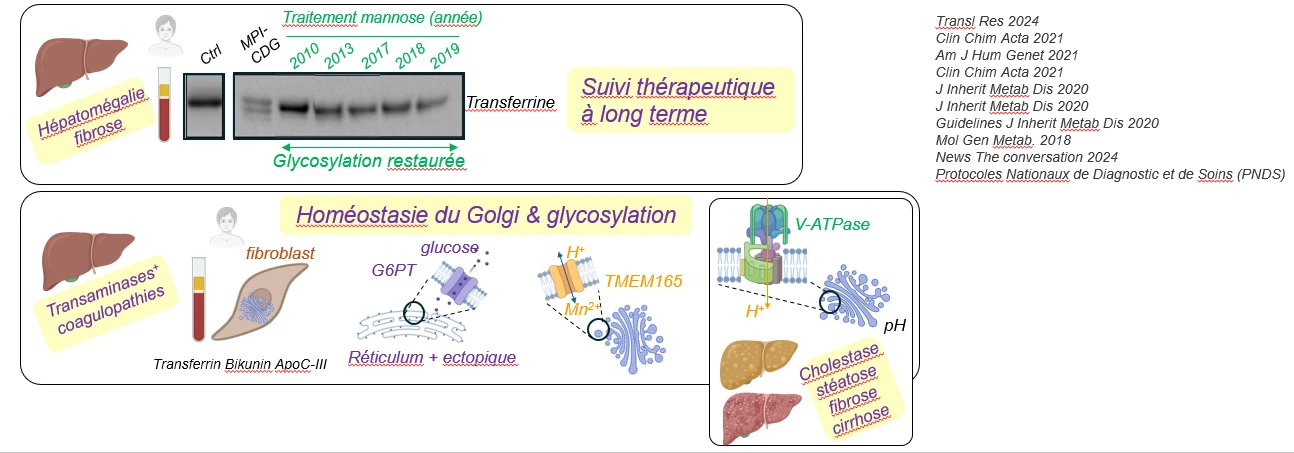
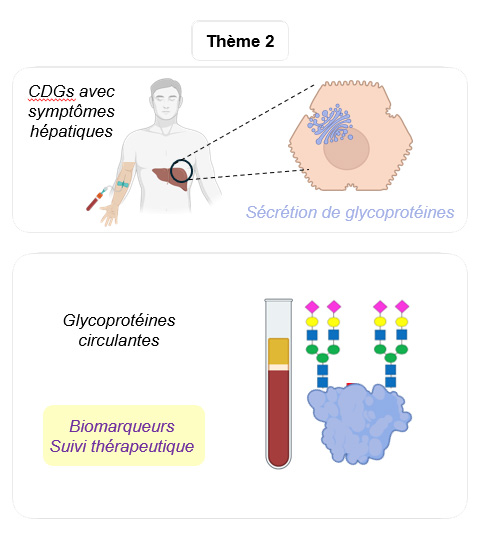
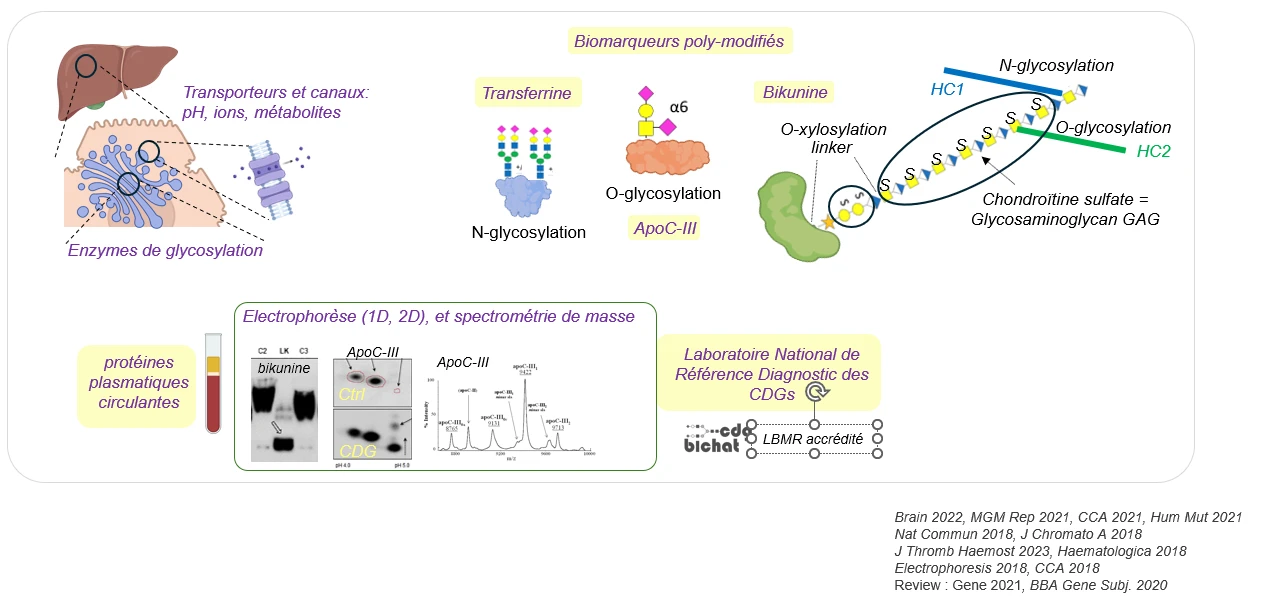
Les biomarqueurs circulants des CDGs : des glycoprotéines poly-modifiées dans l’appareil de Golgi hépatocytaire
Dans les désordres congénitaux de glycosylation (CDGs, Linkéropathies), les patients présentent des symptômes de sévérité variable qui rendent le diagnostic difficile.
La glycosylation des protéines nécessite l’activité de nombreuses enzymes, de transporteurs et de canaux localisés dans l’appareil de Golgi.
Nous avons montré que parmi les glycoprotéines sécrétées par les hépatocytes dans la circulation sanguine, la Transferrine, l’Apoliprotéine C-III et la Bikunine sont facilement accessibles pour analyser la glycosylation et faciliter le diagnostic.
Les gènes altérés dans les CDGs et les phénotypes hépatiques associés
Des anomalies de glycosylation sont observées lorsque le métabolisme/transport des sucres est altéré (mannose phosphate isomérase MPI, phosphomannomutase PMM2 ou glucose G6PT transporteur), ou lorsque que le transport ionique et le pH golgien sont affectés (Mn2+/H+ TMEM165 transporteur, V-ATPase pompe à proton).
Suivant les mutations, les patients présentent des défauts hépatiques plus ou moins sévères, avec des taux de transaminases élevées et des troubles de la coagulation (G6PT, TMEM65, V-ATPase), des hépatomégalies associées à de la fibrose (MPI) et éventuellement des cholestases et stéatoses qui peuvent évoluer vers de la cirrhose (V-ATPase).
D’autres symptômes sont aussi possibles, notamment des symptômes cérébraux et/ou osseux (PAPS SLC35B2 transporteur affectant la sulfatation de protéoglycanes de la matrice extra-cellulaire, pompe V-ATPase, Ca2+ SLC10A7 transporteur de la membrane plasmique, PMM2 phosphomannomutase, Mn2+/H+ TMEM165 transporteur).
La prise en charge médicale repose sur l’utilisation des marqueurs hépatiques circulants (Transferrine, ApoC-III et Bikunine) pour orienter le diagnostic du type de CDG puis l’analyse génétique.
Pour les patients MPI ou TMEM65, des supplémentations en mannose ou Mn2+/galactose respectivement permettent de restaurer un niveau de glycosylation normal et d’atténuer les symptômes.