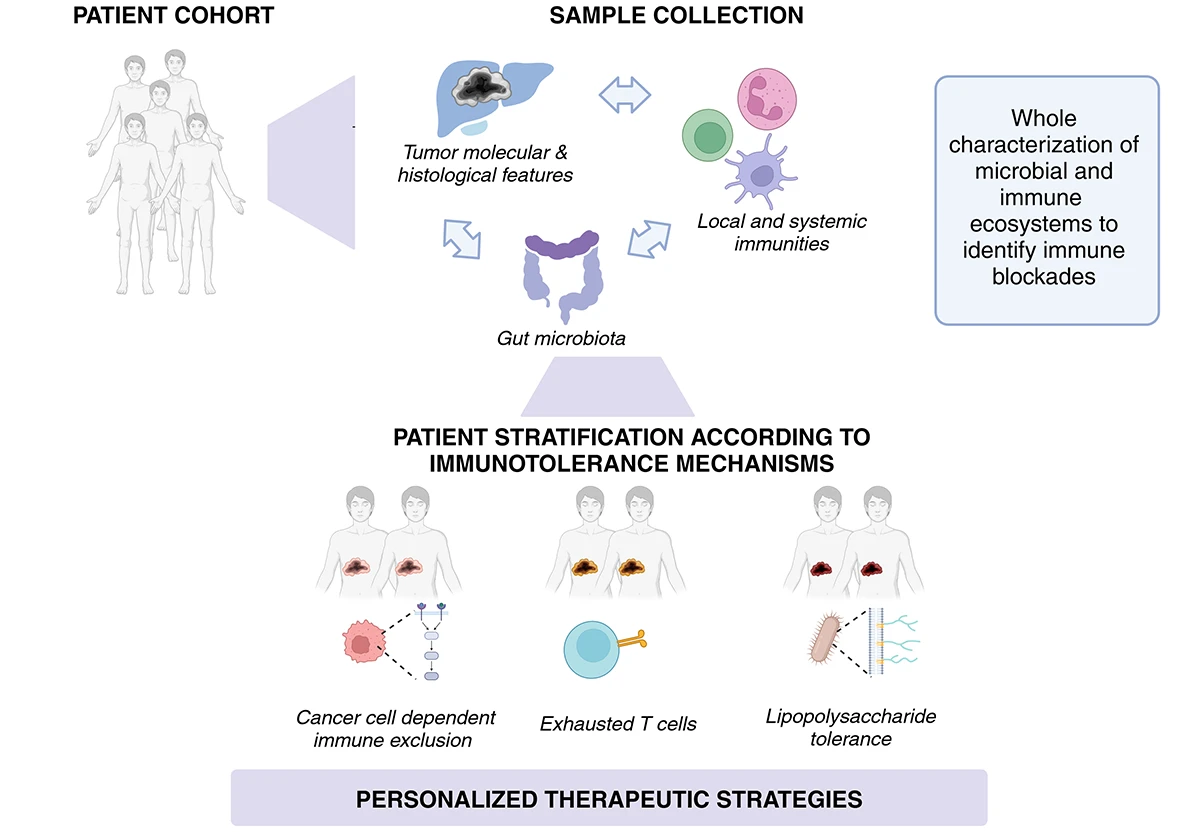
Les cancers primitifs du foie se développent au sein d’un microenvironnement complexe, où les cellules tumorales interagissent étroitement avec les cellules immunitaires, les cellules stromales et la matrice extracellulaire. Ce microenvironnement est fortement influencé par le tube digestif, principal réservoir du microbiote intestinal, dont les dérivés bactériens transitent vers le foie via l’axe intestin-foie. Ces bactéries et leurs métabolites peuvent moduler l’immunophénotype tumoral, influençant l’immunité locale, la tolérance tumorale et la réponse aux traitements.
Notre équipe étudie le microenvironnement tumoral et son rôle dans l’immunotolérance des cancers primitifs du foie, en particulier le carcinome hépatocellulaire (HCC) et le cholangiocarcinome intrahépatique (ICC). Forts de notre expertise dans ce domaine, nous analysons les interactions entre les cellules tumorales, le système immunitaire et l’écosystème microbien afin d’identifier de nouveaux leviers thérapeutiques. Nous explorons notamment l’influence du microbiote intestinal, de ses produits bactériens et de certains effecteurs de l’immunité innée sur la physiopathologie et l’immunité tumorale. L’objectif de nos recherches est d’identifier des biomarqueurs microbiens et de développer des stratégies innovantes visant à optimiser la réponse aux immunothérapies.
Nos recherches s’articulent autour de 3 axes complémentaires : (1) décrypter les mécanismes d’immunotolérance hépatiques et loco-régionaux et identifier leur lien avec le microbiote chez l’homme, (2) montrer la capacité de certains microbes ou produits microbiens à lever l’immunosuppression tumorale dans des modèles précliniques et (3) étudier de l’impact d’un effecteur de l’immunité innée, REG3A, sur l’homéostasie des organes et la cancérogenèse hépatique.
L’immunotolérance tumorale est un obstacle majeur à l’efficacité des immunothérapies dans les cancers primitifs du foie. Grâce à une approche intégrative combinant analyses immunologiques, transcriptomiques et métabolomiques, notre équipe a été pionnière dans l’identification et la caractérisation des immunophénotypes et des mécanismes d’immunotolérance sous-jacents présents dans les tumeurs d’ICC et de HCC (Job et al. 2020 ; Shalhoub et al. 2024).
Nos recherches actuelles visent à décrypter les interactions complexes entre le microenvironnement tumoral, l’immunité locale et systémique, et le microbiote intestinal afin de mieux comprendre la physiopathologie de ces cancers et d’identifier de nouvelles cibles thérapeutiques.
En nous appuyant sur les cohortes de patients suivis au Centre Hépatobiliaire (CHB), nous poursuivons trois objectifs principaux :
Ces travaux permettent d’identifier des biomarqueurs métagénomiques et immunologiques prédictifs de la réponse aux immunothérapies, et ouvrent la voie à des approches de médecine personnalisée, à valider par des modèles précliniques dans le cadre de l’Axe 2.
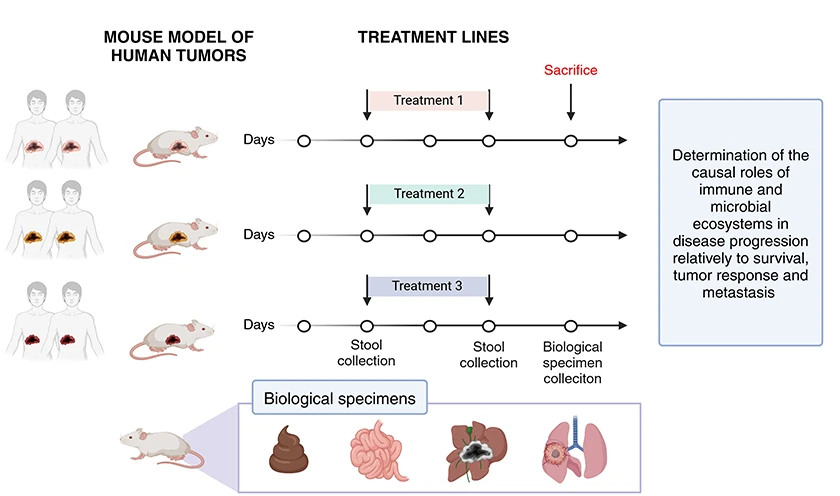
Le microbiote intestinal exerce une influence directe sur la progression des cancers primitifs du foie, notamment via la circulation portale et l’interface immunitaire. Si son rôle est désormais bien établi dans les maladies hépatiques chroniques telles que la stéatohépatite métabolique (MASH), son impact sur la cancérogenèse hépatique reste encore insuffisamment caractérisé.
Notre objectif est d’explorer le potentiel de régulateurs microbiens à remodeler le microenvironnement tumoral immunosuppressif en un phénotype immunoactif, susceptible de freiner la progression tumorale. Nos travaux ont déjà mis en lumière le rôle central de REG3A, un peptide antimicrobien et antioxydant issu de l’immunité innée, dans le contrôle de la diversité microbienne et la production de métabolites immunomodulateurs. Ces propriétés positionnent REG3A comme un levier thérapeutique prometteur pour lever l’immunotolérance tumorale et restaurer l’efficacité des traitements (Moniaux et al. 2024 ; Darnaud et al. 2018).
Dans ce cadre, nous visons à démontrer expérimentalement le rôle causal du microbiote intestinal et de ses dérivés dans :
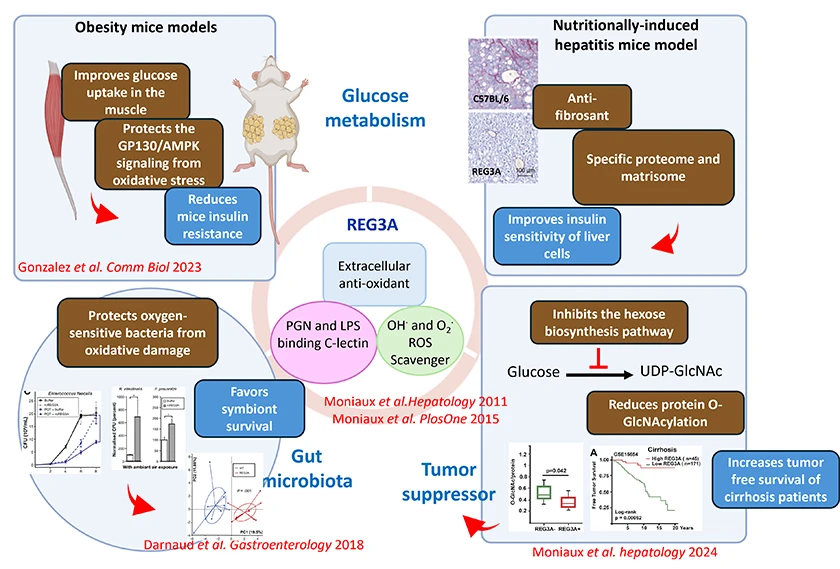
REG3A est une lectine de type C, effecteur de l’immunité innée, dotée de propriétés antioxydantes lui permettant de piéger les espèces réactives de l’oxygène (ROS). Elle joue un rôle central à l’interface entre microbiote intestinal et homéostasie des organes, en agissant à la fois sur l’hôte et sur sa flore commensale. Nos travaux ont mis en évidence plusieurs fonctions clés de REG3A :
Perspectives
Nos travaux futurs visent à décrypter les mécanismes par lesquels REG3A module l’interaction entre microbiote, métabolome et écosystème immunitaire hépatique, dans le contexte de la maladie métabolique d’origine nutritionnelle et des cancers primitifs du foie. Deux axes principaux seront explorés :
Ces recherches s’appuient sur une approche intégrative et translationnelle, combinant analyses métagénomiques, transcriptomiques, métabolomiques et immunologiques, en partenariat étroit avec des cliniciens et des entreprises de biotechnologie spécialisées en immunothérapie.
À terme, ces travaux pourraient aboutir à la mise au point de stratégies thérapeutiques combinées, associant modulation du microbiote et immunothérapie, pour améliorer significativement la prise en charge des patients atteints de carcinome hépatocellulaire (HCC) ou de cholangiocarcinome intrahépatique (ICC).
Données Haut débit

Imagerie
Modèles animaux

Biologie moléculaire et cellulaire













